TENDANCES
Comparateur
- AUTO
La sclérose en plaques (SEP) est souvent décrite comme une maladie unique aux trajectoires multiples. En réalité, deux patients présentant un diagnostic similaire peuvent évoluer de manière très différente, avec des réponses contrastées aux traitements. Une équipe de chercheurs associant l’University College London (UCL) et Queen Square Analytics propose aujourd’hui une lecture plus biologique de la SEP : en combinant intelligence artificielle, imagerie par IRM et un marqueur sanguin de lésion neuronale, les scientifiques identifient deux profils distincts, susceptibles d’ouvrir la voie à un suivi plus fin et, à terme, à des stratégies thérapeutiques mieux ciblées.
Le travail s’appuie sur un constat largement partagé en neurologie : les catégories actuelles — formes rémittentes, progressives, etc. — décrivent bien le déroulé clinique, mais capturent imparfaitement ce qui se passe dans le tissu cérébral. Or, dans la SEP, l’inflammation, la formation de lésions et la neurodégénérescence ne se manifestent pas toujours dans le même ordre, ni avec la même intensité.
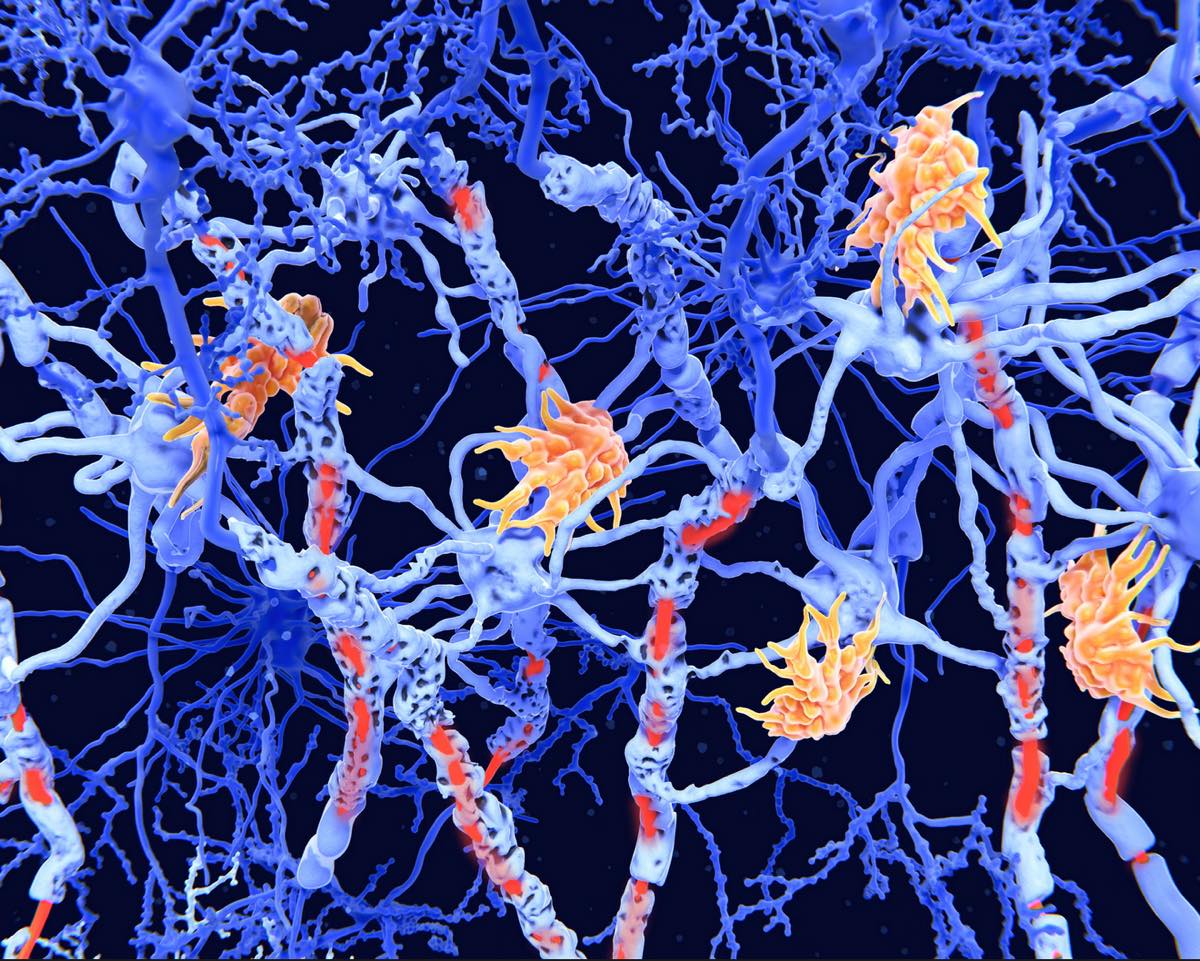
Les chercheurs décrivent deux sous-types qu’ils distinguent par le moment où s’élève un biomarqueur appelé sNfL (serum neurofilament light chain). Ce marqueur, mesuré dans le sang, est considéré comme un indicateur indirect de l’atteinte des fibres nerveuses : plus il est élevé, plus il suggère une activité de lésions axonales importante.
Dans le premier sous-type, l’augmentation du sNfL intervient tôt dans l’histoire de la maladie. Ce signal biologique s’accompagne d’indices d’atteinte du corps calleux et d’une accumulation plus rapide de lésions visibles à l’IRM. Autrement dit, l’inflammation et la neurodégénérescence semblent se déployer de façon très active dès les premières étapes, ce qui correspond à un risque plus élevé d’événements radiologiques (nouvelles lésions) à court terme.
Dans les données analysées, ce sous-type apparaît plus fréquent chez des patients plus jeunes et plus actifs sur le plan radiologique. C’est typiquement le profil que les cliniciens cherchent à repérer tôt, car une prise en charge intensive et un suivi rapproché peuvent être décisifs pour limiter la cascade de dommages.
Le second sous-type suit un scénario différent : l’IRM montre d’abord une perte de volume (atrophie) dans des régions impliquées dans les fonctions cognitives et émotionnelles, notamment le cortex limbique et certaines structures de la substance grise profonde. L’élévation du sNfL survient plus tard au cours de la progression des anomalies. Cette séquence suggère une dynamique où la dégénérescence tissulaire prend de l’avance, avant que le marqueur sanguin ne s’installe franchement.
Dans cette logique, l’activité inflammatoire classique (comme la multiplication rapide de lésions actives) n’est pas forcément l’élément dominant au départ. Cela pourrait expliquer pourquoi certains patients évoluent vers des troubles plus diffus, parfois moins spectaculaires à court terme, mais plus difficiles à enrayer sur la durée.
La nouveauté ne tient pas seulement au biomarqueur, ni à l’IRM, déjà largement utilisés dans la SEP. L’originalité vient de la combinaison des deux, orchestrée par un modèle d’apprentissage automatique conçu pour inférer à la fois un sous-type et un « stade » d’évolution : SuStaIn (SubType and Stage INference). Plutôt que de classer les patients à partir d’une photographie unique, l’algorithme reconstruit une trajectoire probable d’accumulation d’anomalies.
Les chercheurs ont entraîné le modèle sur des données issues d’un essai clinique (phase 2) et l’ont testé sur une cohorte indépendante (phase 3) composée de patients beaucoup plus tôt dans leur parcours, incluant des personnes correspondant à ce que l’on appelait historiquement un « syndrome cliniquement isolé » dans d’anciens critères diagnostiques. Au total, l’analyse porte sur 634 participants, avec des milliers de visites et d’examens regroupés, afin de capturer différentes étapes de la maladie.
Cette architecture est importante : une IA peut être impressionnante sur un jeu de données « maison » et perdre en fiabilité lorsqu’elle change d’hôpital, de population ou de protocole d’imagerie. Ici, le fait de tester le modèle sur une cohorte plus jeune et plus précoce vise précisément à démontrer une capacité de généralisation.
À court terme, cette proposition ne remplace pas les catégories cliniques utilisées au quotidien. Mais elle apporte une piste solide : passer d’un diagnostic essentiellement descriptif à une stratification plus mécanistique, capable d’aider à décider qui nécessite une intensification rapide du traitement, qui doit être surveillé différemment, et quels patients devraient être prioritaires pour certaines études cliniques.
Dans la SEP, le choix d’un traitement repose sur un équilibre délicat entre efficacité attendue et profil de tolérance. Si un sous-type early-sNfL est associé à une activité plus agressive, il pourrait justifier plus tôt des stratégies thérapeutiques à plus forte efficacité, avec une surveillance rapprochée. À l’inverse, un sous-type late-sNfL pourrait encourager des approches complémentaires qui mettent davantage l’accent sur la neuroprotection, la préservation de la substance grise et la prévention de l’atrophie.
Autre enjeu majeur : les essais cliniques. Beaucoup d’études échouent non pas parce qu’un traitement est inutile, mais parce que les participants recrutés sont trop hétérogènes. Des sous-types biologiques plus nets peuvent aider à mieux sélectionner les profils, à réduire le « bruit » statistique, et à mesurer l’effet d’un médicament sur la bonne mécanique (inflammation, neurodégénérescence, ou les deux).
Le sNfL a un avantage : il s’obtient via une prise de sang, donc potentiellement plus facile à répéter qu’une IRM. Pour autant, ce marqueur n’est pas spécifique à la SEP : il peut augmenter dans d’autres situations de souffrance neurologique. De plus, l’interprétation dépend de l’âge, du contexte clinique et du protocole de mesure. Le message est clair : ce n’est pas un test diagnostic à lui seul, mais un signal à mettre en perspective avec l’imagerie et l’examen.
Comme toute avancée de médecine de précision, cette classification devra être consolidée : validation sur d’autres populations, harmonisation des mesures biologiques, robustesse face à des IRM réalisées sur des machines et des centres différents, et surtout utilité clinique démontrée dans des parcours de soins réels. Une IA peut bien séparer deux profils sur le papier ; il faut ensuite prouver que cette séparation améliore concrètement la décision thérapeutique et le pronostic à long terme.
Pour le Dr Arman Eshaghi (UCL), l’enjeu est précisément de dépasser une SEP au pluriel mais décrite avec des mots trop généraux : « La sclérose en plaques n’est pas une seule maladie et les sous-types actuels ne décrivent pas les altérations tissulaires sous-jacentes, pourtant indispensables pour la traiter. » Et d’ajouter que l’association d’un modèle d’IA, d’un biomarqueur sanguin largement disponible et de l’IRM permettrait de mettre en évidence deux schémas biologiques clairs susceptibles d’aider à mieux situer chaque patient sur une trajectoire de maladie.
Si ces résultats se confirment, ils pourraient accélérer une évolution déjà en marche : faire de la SEP une maladie classée non seulement par ses symptômes et son rythme, mais par ses mécanismes dominants. Une étape qui, dans un contexte de traitements de plus en plus spécialisés, pourrait rendre la prise en charge plus lisible pour les équipes médicales… et plus personnalisée pour les patients.
Microsoft a transmis au FBI les clés de récupération nécessaires pour déverrouiller les supports de stockage...
Meta a annoncé la suspension immédiate de l’accès à ses personnages créés par intelligence artificielle...

Netflix démarre fort l’année 2026 avec un mois de février particulièrement chargé en nouveautés....

Chaque jour nous dénichons pour vous des promos sur les produits High-Tech pour vous faire économiser le plus d’argent possible. Voici...

Google et Epic Games ont stupéfié le monde de la tech avec un partenariat confidentiel, mettant un terme inattendu à des...

23 Jan. 2026 • 18:36